Informationstext
Die Wirkungsweise von Katalase und Braunstein im Vergleich
Jede Zelle betreibt Stoffwechsel. Dabei finden in der Zelle über 1 000 verschiedene chemische Reaktionen gleichzeitig statt. Bei jedem dieser Prozesse kommt es zu Energieumwandlungen, bei denen entweder Energie verbraucht oder freigesetzt wird. Diese Umwandlungen entstehen, indem bei der Reaktion chemische Bindungen gelöst und geknüpft, also verändert werden.
In der Regel kann man allerdings davon ausgehen, dass eine Reaktion nur dann spontan abläuft, wenn bei ihr Energie freigesetzt wird und die bei der Reaktion entstehenden Produkte energieärmer sind als die Ausgangsstoffe. Eine Saccharose-Lösung bleibt z. B. bei Zimmertemperatur über einen sehr langen Zeitraum stabil und zerfällt nicht in ihre energieärmeren Produkte Glucose und Fructose. Eine sogenannte Energiebarriere verhindert, dass die Reaktion spontan ablaufen kann. Führt man der Lösung allerdings einen entsprechenden Energiebetrag z. B. in Form von Wärme zu, wird diese Barriere aufgehoben und die Reaktion kann selbstständig ablaufen. Diese zugeführte Energie wird in der Chemie als Aktivierungsenergie bezeichnet.
Da aber die Reaktionsgeschwindigkeit in Zellen nur in Ausnahmesituationen (z. B. Fieber) durch eine Wärmezufuhr erhöht wird, steht Lebewesen eine alternative Vorgehensweise zur Verfügung: die Beschleunigung chemischer Reaktionen durch biologische Katalysatoren. Diese Katalysatoren heißen Enzyme und bestehen meist aus Proteinen. Sie lösen gezielt bestimmte chemische Reaktionen im Körper aus, indem sie deren Aktivierungsenergie herabsetzen. Somit können über Enzyme Stoffwechselreaktionen genau reguliert werden, während eine Erhöhung der Körpertemperatur viel weniger spezifisch wirkt.
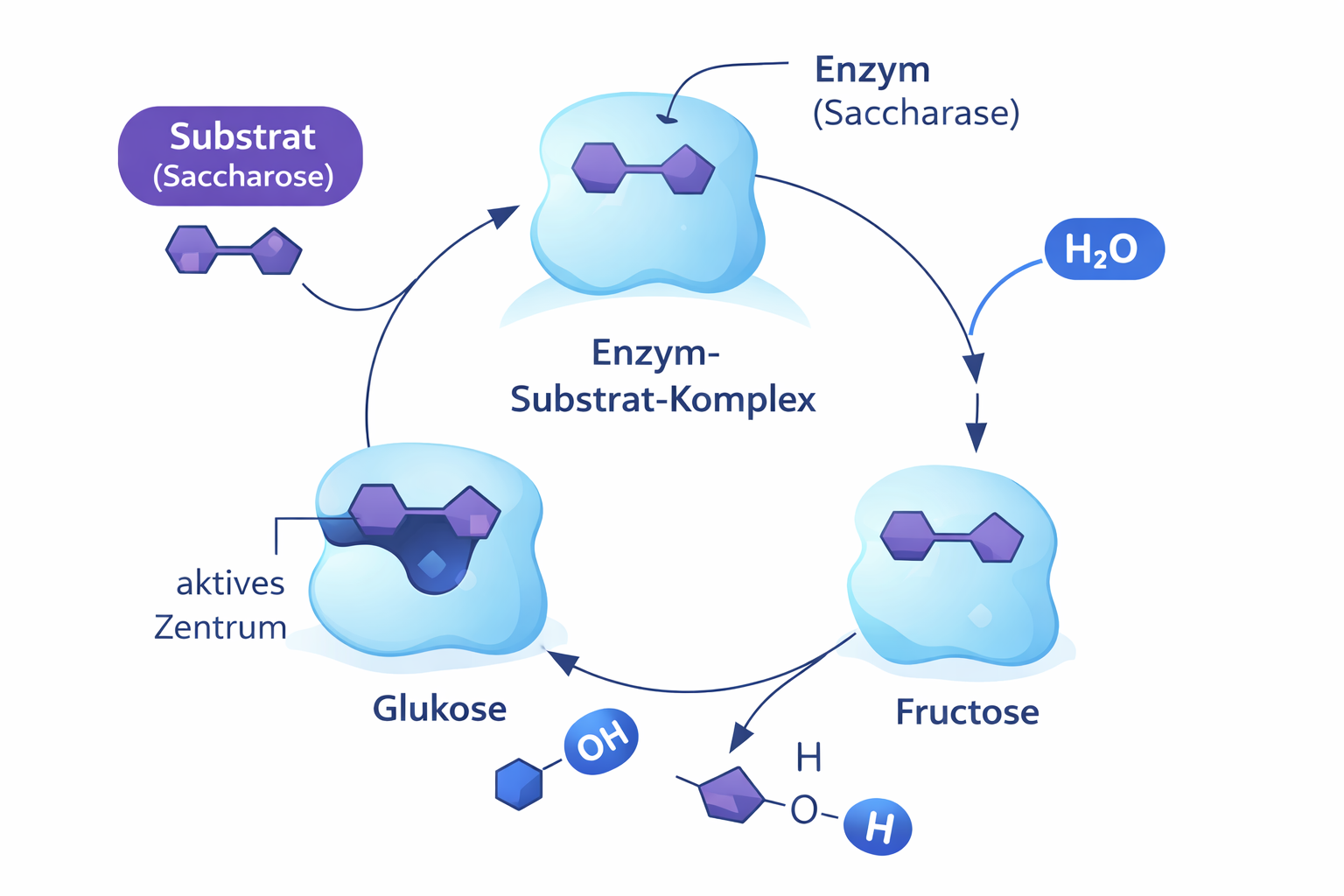
Den Stoff, der von Enzymen umgesetzt wird, bezeichnet man allgemein als Substrat. Damit Enzyme die Aktivierungsenergie herabsetzen können, müssen Enzym- und Substratmolekül miteinander in Wechselwirkung treten und einen Enzym-Substrat-Komplex bilden. Dies ist nur mithilfe der Kräfte möglich, auf die auch die Konformation eines Proteins beruht - also Wasserstoffbrückenbindungen, hydrophobe Wechselwirkungen, sowie den Ladungen einzelner Aminosäuren. Die räumliche Struktur eines Enzyms ist also für dessen katalytische Funktion entscheidend. In einer taschen- oder spaltenförmigen Einbuchtung des Proteinmoleküls, dem aktiven Zentrum, spielt sich die Reaktion ab, nachdem das Substrat hier gebunden wurde. Das aktive Zentrum ist so geformt, dass Moleküle des Substrats hineinpassen wie ein Schlüssel in ein Schloss. Die Wechselwirkungen verändern die räumliche Struktur des spezifischen Substratmoleküls. Das bedeutet, dass (je nach Reaktion) Bindungen innerhalb des Moleküls leichter gebildet oder gebrochen werden können. Die enzymatische Reaktion kann auf molekularer Ebene wie in Abb. 1 veranschaulicht werden.